Chemie
Nächster Kurs: Samstag, 17. Mai 2025, 09 – 12 Uhr
Umfang: 3 Lektionen
Schulstufe: ab dem 8. Schuljahr
Kursleitung: Isabel Nigsch
Veranstaltungsort: ETH Zürich, 8092 Zürich. Der genaue Veranstaltungsort an der ETH Zürich wird kurz vor Kursbeginn bekanntgegeben, damit wir die Raumgrösse flexibel planen können.
Anmeldung: externe Seite zum Anmeldeformular
Sie können sich bis zu zwei Tage vor Kursbeginn anmelden. Melden Sie sich bei Schwierigkeiten unter bei uns.

Chemie des Klimawandels – Teil 1: Wie nehmen Treibhausgase wie Kohlenstoffdioxid, Methan und Wasserdampf Einfluss auf das Klima?
Im Mittelpunkt dieses Kurses stehen die chemischen Prozesse, die sowohl dem natürlichen als auch dem anthropogenen Treibhauseffekt zugrunde liegen. Auf welche Weise sorgt der Treibhauseffekt dafür, dass auf der Erde Temperaturen herrschen, die Leben ermöglichen, und welche Prozesse führen gegenwärtig zu einer globalen Erwärmung? Welche Rolle spielen Treibhausgase wie Kohlenstoffdioxid und Wasserdampf in der Atmosphäre beim Treibhauseffekt – und welche Zusammenhänge werden in den Medien oft falsch dargestellt? Wie können wir die mittlere Temperatur der Erde berechnen und erklären, wie Albedo und Treibhauseffekt diese Temperatur beeinflussen? Welche Mechanismen liegen natürlichen Klimaschwankungen zugrunde – und wie können wir Leugner des anthropogenen Treibhauseffekts vom Einfluss des Menschen auf das Klima überzeugen?
Mit dem Ausstoss grosser Mengen von Treibhausgasen beeinflussen wir unsere Umwelt auf vielfältige Art und Weise. Wir betrachten den Kohlenstoffkreislauf und suchen Antworten auf die Frage, was genau eine grössere Menge an CO2 in unserer Atmosphäre alles bewirkt. Dabei gehen wir auch auf den Rückkopplungsmechanismus von Kohlenstoffdioxid und Wasserdampf ein. Was sind die Auswirkungen auf die mittlere Erdtemperatur, auf das Klima der Ozeane und Meeresströmungen? Zum Abschluss wird dargestellt, wie sich verschiedene Argumente von Leugnern des Klimawandels durch experimentelle Belege und Messreihen entkräften lassen.
Inhaltsübersicht
- Aufnahme und Abgabe von IR-Strahlung bei Treibhausgasen
- Die Strahlungsbilanz der Erde
- Kohlenstoffdioxid-Emissionen. Der Kohlenstoff-Kreislauf der Erde
- Die Auswirkungen des Klimawandels auf die mittlere globale Temperatur
- Die Argumente der Klimawandel-Leugner – und ihre Widerlegung
Diese Unterrichtseinheit wurde an der ETH Zürich vom MINT-Lernzentrum in Zusammenarbeit mit dem Departement für Umweltsystemwissenschaften entwickelt.


Nächster Kurs: Samstag, 24. Mai 2025, 09 – 12 Uhr
Umfang: 3 Lektionen
Schulstufe: ab dem 8. Schuljahr
Kursleitung: Isabel Nigsch
Veranstaltungsort: ETH Zürich, 8092 Zürich. Der genaue Veranstaltungsort an der ETH Zürich wird mit der Anmeldung bekanntgegeben, damit wir die Raumgrösse flexibel planen können.
Anmeldung: externe Seite zum Anmeldeformular
Sie können sich bis zu zwei Tage vor Kursbeginn anmelden. Melden Sie sich bei Schwierigkeiten unter bei uns.

Chemie des Klimawandels – Teil 2: Warum ist Ozon in der Stratosphäre nützlich (Strahlungsschutz) und in Bodennähe schädlich (Ozonbelastung)?
Das Themengebiet des Klimawandels ist vielseitig. Nachdem Sie im Kurs zur Chemie des Klimawandels Teil 1 oder dem Kurs Physik des Klimawandels bereits Wichtiges über den Klimawandeln erfahren haben, geht es in diesem Kurs darum, mehr über den Aufbau unserer Atmosphäre und den Zusammenhang mit dem Klimawandel zu erfahren. Dabei widmen wir uns im Speziellen einem Molekül: dem Ozon. Wie ist Ozon aufgebaut und wie wird dieses gebildet?

Was versteht man unter einem Ozonloch und wie entstehen solche? Wieso spricht man im Sommer über Ozonbelastung, obwohl uns die Ozonschicht vor gefährlicher Strahlung schützt?

Neben dem Beantworten dieser Fragestellungen beschäftigen wir uns auch mit einigen Alltagsphänomenen: Können Sie beispielswiese erklären, wieso der Himmel blau erscheint, ein schöner Sonnenuntergang aber in roten und orangen Farbtönen leuchtet? Haben Sie sich schon einmal gefragt, wieso man ab einer gewissen Höhe keine Wolken mehr beobachten kann?
Diese Unterrichtseinheit wurde an der ETH Zürich vom MINT-Lernzentrum in Zusammenarbeit mit dem Departement für Umweltsystemwissenschaften entwickelt.
Inhaltsübersicht
- Struktur und Eigenschaften des Ozons
- Aufbau der Erdatmosphäre
- Ozon in der Stratosphäre
- Ozon in der Troposphäre

Nächster Kurs: Samstags, 28. Juni & 05. Juli 2025, 09 – 14 Uhr
Umfang: 10 Lektionen
Schulstufe: ab dem 09. Schuljahr (Lest Euch den Text einfach mal durch und schaut, ob das etwas für Euch ist.)
Kursleitung: Isabel Nigsch
Veranstaltungsort: ETH Zürich, 8092 Zürich. Der genaue Veranstaltungsort an der ETH Zürich wird mit der Anmeldung bekanntgegeben, damit wir die Raumgrösse flexibel planen können.
Anmeldung: externe Seite zum Anmeldeformular
Sie können sich bis zu zwei Tage vor Kursbeginn anmelden. Melden Sie sich bei Schwierigkeiten unter bei uns.
Chemische Einblicke in die Genetik: Werkzeuge der modernen Medizin
Entdecke die faszinierende Welt der Biochemie und Genetik!
Chemisches Grundwissen ist der Schlüssel, um die komplexen genetischen Prozesse des Lebens zu entschlüsseln. In diesem Kurs machen wir uns auf eine Entdeckungsreise, bei der du erfährst, wie die moderne Forschung chemische Werkzeuge einsetzt, um gezielt in unsere Biologie einzugreifen. Lerne, wie biochemisches Wissen die medizinische Forschung revolutioniert und entdecke, wie die Zusammenarbeit von Chemie und Biologie innovative Therapieansätze hervorbringt.
Von der DNA zum Protein – eine chemische Rundfahrt
Wir starten unsere Reise bei der DNA, dem molekularen Träger der genetischen Information, und verfolgen ihren Weg bis hin zum Protein. An verschiedenen Haltepunkten untersuchen wir mit Chemiewissen, welche chemischen Konzepte eine Rolle spielen. Dabei folgen wir den zentralen Ideen der Genetik und entschlüsseln die Prozesse der Genexpression.
Chemische Vertiegungen:
A. Kovalente Bindung vs. Zwischenmolekulare Kräfte
B. Zuckerchemie
C. DNA vs RNA
D. Ribozyme vs Enzyme
E. Acetylsalicylsäure
F. Bindungsspezifität
G. Eigenschaften der Zellmembran
H. Chiralität
Chemie als Schlüssel zur modernen Medizin
Oligonukleotide als Wirkstoffe haben die moderne Medizin revolutioniert. Pharmaunternehmen wie Roche entwickeln hochpräzise Medikamente, die gezielt an DNA oder RNA binden. Diese bahnbrechenden Technologien ermöglichen die Behandlung genetischer Krankheiten wie der Spinalen Muskelatrophie (SMA) und bieten neue Hoffnung für viele Patienten.
Im Kurs werden wir die folgenden Fragen beantworten:
- Wie stabilisiert sich die DNA durch Basenpaarung?
- Warum ist RNA weniger beständig als DNA?
- Wie beeinflusst das alternative Spleissen die Proteinvielfalt? Welche Rolle spielt das Spleissosom dabei?
- Wie kann die Bindungsspezifität von Enzymen erklärt werden?
- Welche chemischen Eigenschaften hat die Zellmembran?
- Wie können Oligonukleotide genutzt werden, um genetische Erkrankungen zu behandeln?
- Welchen Einfluss hat die Chiralität der Nukleinsäuren?
Legende:
- DNA: Desoxyribonukleinsäure – Träger der gesamten genetischen Information.
- RNA: Ribonukleinsäure – Oberbegriff für alle RNA-Formen mit unterschiedlichen Funktionen.
- mRNA: Messenger-RNA (Boten-RNA) – RNA-Molekül, das die genetische Information für die Proteinbiosynthese überträgt.
- prä-mRNA: Vorläufer-mRNA – Unreife mRNA, die unmittelbar nach der Transkription entsteht und noch verarbeitet werden muss
Um diese Themen wird es im Einzelnen gehen:
In diesem Kurs begeben wir uns auf eine Panoramafahrt von der DNA bis zum Protein. Wir werden an verschieden Stellen der Rundfahrt aussteigen und mit dem chemischen Wissen aus der Schule die Wechselwirkungen genauer anschauen. Dabei folgen wir den zentralen Ideen der Genetik. Diese beschreiben die Weitergabe der Information der DNA.
1) Genexpression: Von der DNA zum Protein
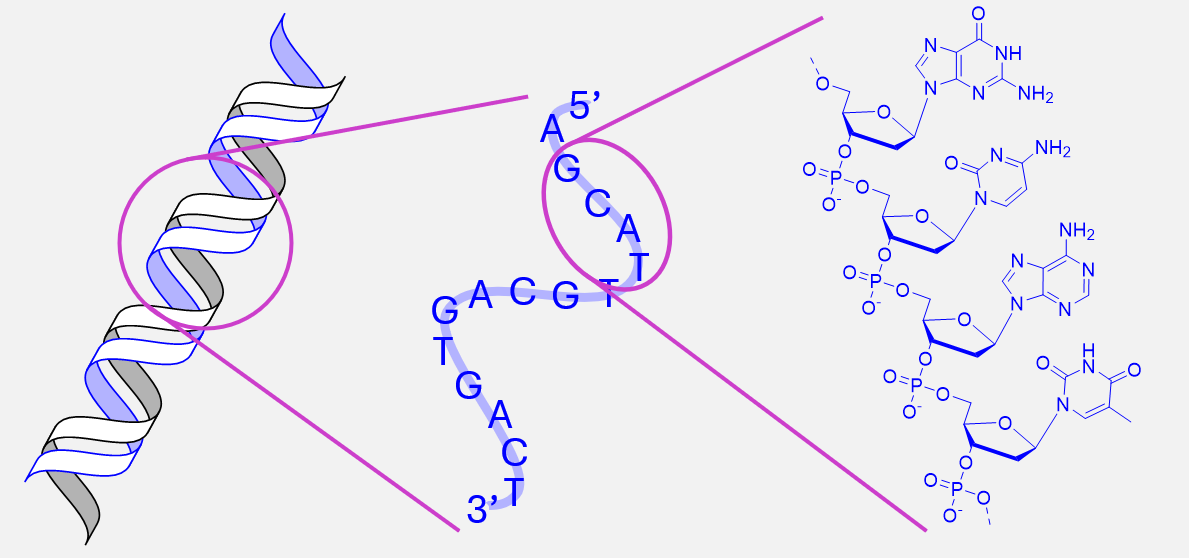
Jedes Lebewesen besitzt eine einzigartige Kombination von Eigenschaften, die durch die genetische Information in der DNA bestimmt wird. DNA und RNA sind Nukleinsäuren, die aus einem Zucker-Phosphat-Rückgrat mit angehängten Nukleinbasen bestehen. Die DNA bildet eine Doppelhelix mit zwei antiparallel verlaufenden Strängen, die durch spezifische Basenpaarung stabilisiert wird.
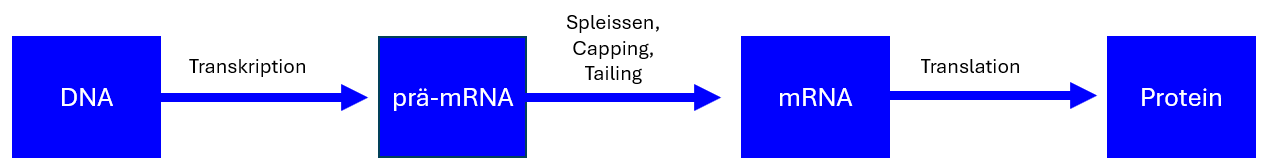
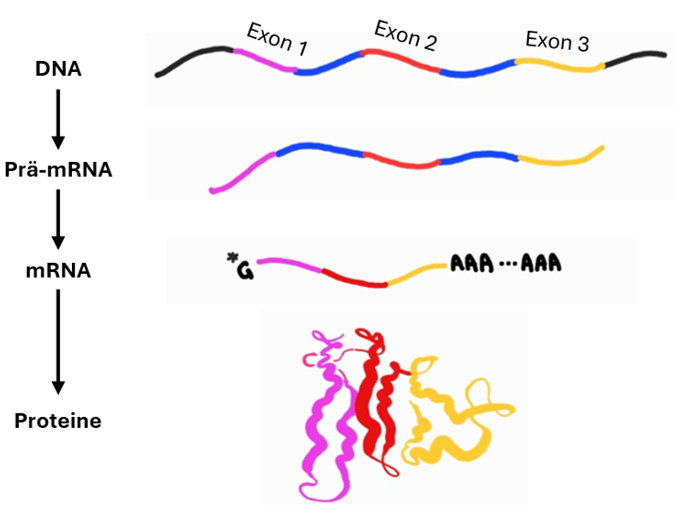
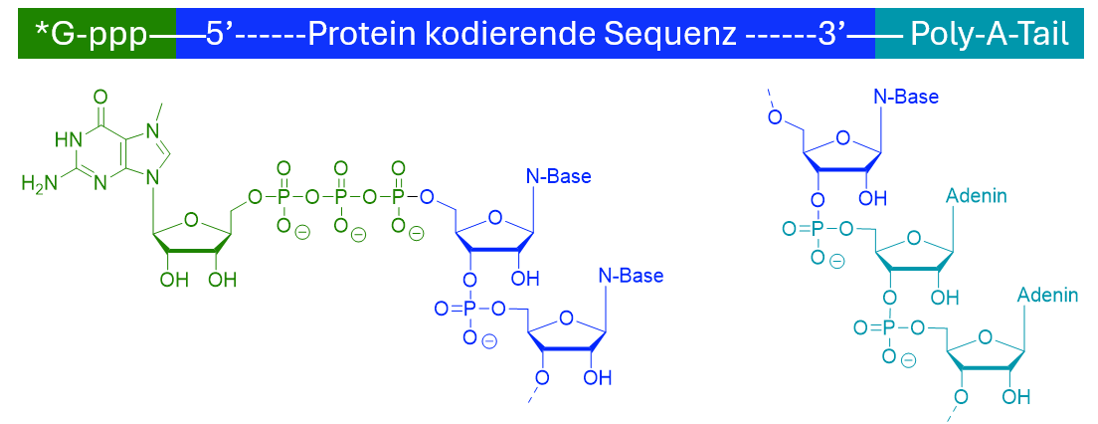
Die Verarbeitung von mRNA ist entscheidend für die Genexpression. Prä-mRNA besteht aus kodierenden Exons und nicht kodierenden Introns. Durch das Spleissen werden Introns entfernt und Exons miteinander verbunden. Die mRNA wird zusätzlich durch eine 5'-Cap-Struktur und eine Poly-A-Sequenz am 3'-Ende stabilisiert. Das Spleissosom katalysiert diesen Prozess mit hoher Präzision durch Watson-Crick-Basenpaarung.
Alternatives Spleissen erhöht die Vielfalt der Proteine aus einem Gen, indem Exons in unterschiedlicher Kombination verbunden werden. Dies fördert die genetische Vielfalt, ohne dass das Genom an Länge zunehmen muss.
Die "Ein-Gen-ein-Protein"-Hypothese von Beadle und Tatum wurde widerlegt, weil alternatives Spleissen zeigt, dass ein Gen mehrere Proteinvarianten codieren kann. Dies erklärt, wie die relativ kurze menschliche DNA eine hohe Proteindiversität ermöglicht.
2) Oligonukleotide beeinflussen die Genexpression
Oligonukleotide sind kurze Nukleotidketten mit maximal 50 Basen, während DNA und RNA deutlich länger sind. Sie können die Genexpression beeinflussen, indem sie entweder die Proteinexpression reduzieren oder das prä-mRNA-Spleissen modifizieren.
Ein Gene Knockdown oder Knockout erfolgt durch Antisense-Oligonukleotide (ASOs) oder small interfering RNAs (siRNAs), die an Ziel-mRNA binden und deren Abbau bewirken. Während ein Knockout die Proteinexpression vollständig stoppt, reduziert ein Knockdown die Proteinmenge erheblich.
Splice-Switching-Oligonukleotide (SSOs) modifizieren die prä-mRNA, ohne sie abzubauen. Sie binden an spezifische Sequenzen und beeinflussen das Spleissen, wodurch alternative mRNA-Varianten entstehen, die zu veränderten Proteinen führen.
3) Das Besondere an Oligonukleotiden
Oligonukleotide sind eine vielversprechende Wirkstoffklasse, die gezielt in die Regulation der Genexpression eingreifen können. Dies macht sie für die moderne Medizin besonders attraktiv.
Oligonukleotide ermöglichen eine gezielte und rationale Wirkstoffentwicklung, da sie direkt an eine spezifische DNA- oder RNA-Sequenz binden können. Dies erfolgt durch Watson-Crick-Basenpaarung, wodurch gezielt bestimmte Gene reguliert werden können. Diese hohe Spezifität verringert das Risiko unerwünschter Wechselwirkungen mit anderen Zielstrukturen.
Oligonukleotide sind grosse, geladene Moleküle, die nicht einfach durch Zellmembranen diffundieren können. Daher müssen sie oft per Injektion verabreicht werden. Um die Aufnahme von Oligonukleotiden in bestimmte Organe oder Zellen zu verbessern, werden sie oft mit speziellen Molekülen wie Liganden, Zuckern, Lipiden, Peptiden oder Antikörpern gekoppelt. Diese biokonjugierten Moleküle binden an spezifische Zellrezeptoren und ermöglichen eine gezielte Aufnahme durch Rezeptor-vermittelte Endozytose, wodurch die Wirksamkeit der Therapie erhöht wird.
4) Spinale Muskelatrophie (SMA)
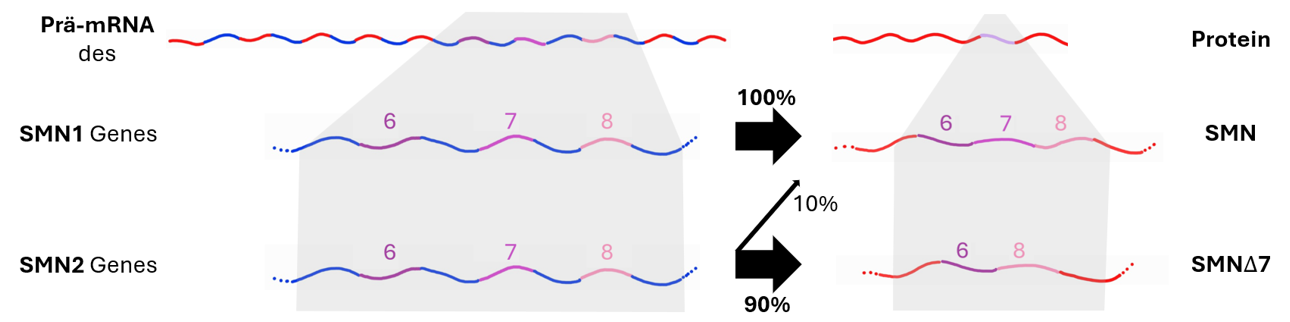
Spinale Muskelatrophie (SMA) ist eine genetische Erkrankung, die durch den Mangel an funktionalem SMN-Protein verursacht wird. Dies führt zu fortschreitender Muskelschwäche und ist die häufigste genetische Ursache für frühkindlichen Tod.
SMA entsteht durch Mutationen im SMN1-Gen, das für funktionales SMN-Protein kodiert. SMN2 produziert aufgrund eines Splicing-Fehlers meist nur eine funktionslose Variante (SMNΔ7), sodass die Proteinmenge unzureichend ist.
Nusinersen (Spinraza) korrigiert den Splicing-Fehler im SMN2-Gen und steigert so die Produktion von funktionsfähigem SMN-Protein. Es wird direkt in den Liquorraum des Rückenmarks injiziert.
Nächster Kurs: Wir werden in Kürze einen Termin veröffentlichen. Sie können sich bereits jetzt für diesen Kurs voranmelden. Wir benachrichtigen Sie, sobald ein Termin feststeht.
Umfang: 11 Lektionen
Schulstufe: ab dem 9. Schuljahr
Kursleitung: Dr. Adrian Zwyssig
Veranstaltungsort: ETH Zürich, 8092 Zürich. Der genaue Veranstaltungsort an der ETH Zürich wird mit der Anmeldung bekanntgegeben, damit wir die Raumgrösse flexibel planen können.
Voranmeldung: externe Seite zum Voranmeldeformular
Sie können sich bis zu zwei Tage vor Kursbeginn anmelden. Melden Sie sich bei Schwierigkeiten unter bei uns.
Einführung zu den chemischen Bindungen – Was hält die Atome in Stoffen zusammen?
Die Welt, wie wir sie kennen und erleben, besteht aus einer Vielzahl von Stoffen. Diese Stoffe wiederum bestehen aus Atomen. Doch was führt dazu, dass diese Atome in diesen Stoffen zusammengehalten werden und nicht in ihre Einzelatome zerfallen? Können wir diese Anziehungskräfte genauer beschreiben und gibt es gar unterschiedliche Möglichkeiten für den Zusammenhalt?
Betrachten Sie beispielsweise die Stoffe Wasser, Natriumchlorid (Kochsalz) und Diamant.

Auf den ersten Blick sind visuelle Ähnlichkeiten zu beobachten, wie die kristalline Form oder die Durchsichtigkeit der Stoffe. Betrachtet man aber die Schmelzpunkte, muss man sich die Frage stellen, woher diese grossen Unterschiede in den Anziehungskräften stammen.

Atome sind elektrisch neutral, da sie über gleich viele Elektronen wie Protonen verfügen. Dennoch muss es offenbar Mechanismen geben, die diese zusammenhalten. Auf der Grundlage des Konzepts der Anziehung positiver und negativer Ladung, dem Coulombgesetz, sowie der Elektronegativität werden in diesem Einführungskurs die drei verschiedenen Bindungsmöglichkeiten vorgestellt: die ionische, die metallische und die kovalente Bindung.
Im weiteren Kursverlauf werden die drei Bindungsarten genauer beleuchtet und Vertreter der jeweiligen Stoffklasse mittels Experimenten genauer auf deren Eigenschaften untersucht. Den roten Faden bieten dabei Experimente zur elektrischen Leitfähigkeit, anhand derer die jeweiligen Bindungsarten eingeführt werden sowie die folgende Übersichtsgrafik.

Inhaltsübersicht
1. Übersicht über die drei Bindungsarten
2. Ionische Bindungen
3. Metallische Bindungen
4. Kovalente Bindungen
Nächster Kurs: Wir werden in Kürze einen Termin veröffentlichen. Sie können sich bereits jetzt für diesen Kurs voranmelden. Wir benachrichtigen Sie, sobald ein Termin feststeht.
Umfang: 5 Lektionen
Schulstufe: ab dem 09. Schuljahr
Kursleitung: Isabel Nigsch
Veranstaltungsort: ETH Zürich, 8092 Zürich. Der genaue Veranstaltungsort an der ETH Zürich wird mit der Anmeldung bekanntgegeben, damit wir die Raumgrösse flexibel planen können.
Voranmeldung: externe Seite zum Voranmeldeformular
Sie können sich bis zu zwei Tage vor Kursbeginn anmelden. Melden Sie sich bei Schwierigkeiten unter bei uns.

Welche chemische Reaktion ist dafür verantwortlich, dass in Batterien Elektronen fliessen? Woher kommen die Elektronen einer Batterie – und wohin gehen sie? Warum sind Akkus im Unterschied zu Batterien wiederaufladbar? Und nach welchem Prinzip funktionieren Brennstoffzellen: Ist das ähnlich wie bei Batterien und Akkus – oder ganz anders? Das sind die Fragen, die in diesem Kurs beantwortet werden. Dabei werden wir Gelegenheit haben, mit ungefährlichen Stoffen selbst verschiedene Batterien zu bauen, wie zum Beispiel eine Aluminium-Luft-Batterie:

Zudem werden wir aus Kupfer und Zink eine weitere Batterie bauen: eine moderne Version der klassischen Volta-Säule. Danach untersuchen wir am Beispiel eines wiederaufladbaren Zink-Jod-Akkus die Unterschiede zwischen Batterien und Akkus. Zum Abschluss befassen wir uns mit der Zukunftstechnologie der Brennstoffzellen (Wasserstoff, Methanol) und erklären am Beispiel der Wasserstoff-Brennstoffzelle, welche chemischen Reaktionen ihnen zugrunde liegen.

Hier findet Ihr einige Experimente, die wir im Kurs durchführen werden:

Wir bauen eine Batterie:
Aus einer Kupfersulfat-Lösung…

…wird mit Gelatine ein Gel hergestellt.

Ebenso mit Zinksulfat.

Werden diese beiden Gele auf eine Kupfer- bzw. Zinkplatte gelegt und anschliessend aufeinandergelegt, …

…so erhält man eine Batterie, mit der man zum Beispiel einen Motor mit Propeller antreiben kann.

Galvanisieren:
In einer Kupfersulfatlösung kann mit Hilfe einer elektrischen Spannung…

… eine Münze galvanisch verkupfert werden.
Wir bauen einen Akku:
Eine Zinkiodid-Lösung kann durch das Anlegen einer elektrischen Spannung in Iod an der einen Elektrode (rötlich-braun, obere Elektrode) und metallisches Zink (silberner Schimmer an Elektrode, untere Elektrode) an der anderen Elektrode aufgespalten werden.


Wird ein Verbraucher angeschlossen, reagieren Zink und Iod wieder zu Zinkiodid. Die dabei freiwerdende Energie treibt den Verbraucher wie zum Beispiel einen Elektromotor mit Propeller an. Somit erhält man wieder das Startmaterial und der Kreislauf kann wieder von vorne beginnen.
Nächster Kurs: Wir werden in Kürze einen Termin veröffentlichen. Sie können sich bereits jetzt für diesen Kurs voranmelden. Wir benachrichtigen Sie, sobald ein Termin feststeht.
Umfang: 4 Lektionen
Schulstufe: ab dem 7. Schuljahr
Kursleitung: Dr. Adrian Zwyssig
Veranstaltungsort: ETH Zürich, 8092 Zürich. Der genaue Veranstaltungsort an der ETH Zürich wird kurz vor Kursbeginn bekanntgegeben, damit wir die Raumgrösse flexibel planen können.
Voranmeldung: externe Seite zum Voranmeldeformular
Melden Sie sich bei Schwierigkeiten unter bei uns.
Einsteigsexperiment: das Blaue Wunder
Dieser Kurs führt dich in die Grundlagen der Chemie ein. Wir beginnen mit dem faszinierenden Experiment des „Blauen Wunders“ und nutzen es, um eigene Hypothesen zu überprüfen. Dabei lernst du, dass Chemie sich mit Stoffumwandlungen beschäftigt und wie man durch Experimente Hypothesen bestätigt oder widerlegt.

Warum wird die Lösung beim Schütteln blau – und warum entfärbt sie sich nachher wieder?
Im Video weiter unten kannst du den Prozess beobachten. Die Antwort werden wir im Kurs gemeinsam finden.
Wie geht man am besten vor, wenn man eine wissenschaftliche Fragestellung anhand Experimente untersuchen möchte?
Wir überlegen uns, welche Bedingungen erfüllt sein müssen, damit Experimente überhaupt aussagekräftig sind. Hier ein Beispiel:
Julia und Noah wollen herausfinden, wovon es abhängt, wie lange eine Brausetablette nach dem Hineinwerfen ins Wasser schäumt. Diese drei Dinge könnten einen Einfluss haben:
• Grösse der Brausetablette
• Menge des Wassers im Glas
• Brausetablette in mehrere Stücke aufbrechen
Schau dir an, welche Experimente Julia und Noah durchgeführt haben:

Können Julia und Noah so herausfinden, wovon es abhängt, wie lange eine Brausetablette nach dem Hineinwerfen in das Wasser schäumt? Oder sollten sie etwas anders machen?
Wie können wir uns die Welt der Atome und der kleinsten Teilchen vorstellen?

Lässt sich Materie unendlich teilen oder gibt es ein "kleinstes Teilchen"? Dieser Fragestellung gehen wir anhand eines Gedankenexperiments nach.
Wie verhalten sich diese kleinsten Teilchen? - Alltagsphänomene besser verstehen!
Hast Du dich schon einmal gefragt, wieso eigentlich die Wäsche trocknet, obwohl gar keine 100 °C herrschen? Warum friert man, wenn Wasser auf der Haut verdunstet? Wieso perlt Wasser auf meiner Regenjacke ab, während das Wasser von meinem T-Shirt aufgesaugt wird?
Anhand von Experimenten und einprägsamen Modellen kannst du solche Phänomene besser verstehen.
Was hält die kleinsten Teilchen zusammen?
Anhand Experimenten untersuchen wir den Zusammenhalt der kleinsten Teilchen untereinander genauer. Was hält diese Teilchen zusammen?
Hast Du schon davon gehört, dass sich positive und negative Ladungen gegenseitig anziehen? Wir untersuchen das für die Chemie sehr wichtige Coulombgesetz - eine wichtige Grundlage für viele Erklärungen in der Chemie.
Wie sind Atome aufgebaut?
Zum Abschluss gehen wir der Frage nach, wie ein Atom aufgebaut ist.
Atome kann man mit blosem Auge nicht beobachten. Welche Experimente gibt es, um dennoch etwas über den Aufbau von Atomen zu erfahren? Wir lernen dabei die drei wichtigsten atomaren Elementarteilchen kennen: Protonen, Neutronen und Elektronen.
Inhaltsübersicht:
- Einführung in den Chemieunterricht. Das Testen von Hypothesen am Beispiel des «Blauen Wunders»
- Stoffe bestehen aus kleinsten Teilchen. Einführung in den Atomismus - eine zentrale Vorstellung der modernen Chemie
- Atome bestehen aus Elementarteilchen.
- Anordnung der Elementarteilchen in einem Atom.